Asîda amînî
Asîda amînî an jî tirşa amînî (bi înglîzî: amino acid) yekeya pêkhateya proteînan ê.
Navê asîda amînî ji navê du koman, koma amînî û koma asîda karboksîlê pêk tê.[1] Her çiqas navê wan asîda amînî be jî, hemû asîdên amînî ne asîdî ne. Asîda glutamî (glutamic acid) û asîda aspartî (aspartic acid) taybetmendiyên asîdê lixwe digirin loma wekî asîd tên hesibandin.[2]
Di laşê mirov de gellek erkên asîdên amînî hene. Di pêkhateya proteînan de cihgirtin, erkê sereke yê asîdên amînî ye. Lê di xaneyê de asîdên amînî ji bo çêkirina bazên nîtrojenî yên nukleotîdên ADN, ARN-yê jî tên bikaranîn. Herwisa hin hormon û demareguhêzer (bî înglîzî: neurotransmitter) jî ji asîdên amînî peyda dibin.[3]
Ji bo kurtenavê asîda amînî sê tîp an jî tîpek tê bikaranin. Wekî mînak kurtenavê asîda amînê ya alanîn “Ala”, an jî “A” ye ( Alanîn= Ala= A)[4]Herwisa peyava asîda amînî jî bi kurtî wekî “aa” tê nivîsin.
Pêkhate
[biguhêre | çavkaniyê biguhêre]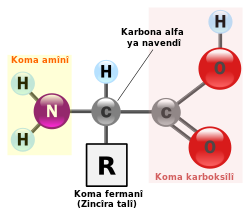
Di hemû asîdên amînî de karbonek navendî heye, ev karbon bi çar bendan bi molekulan ve girêdayî ye û wekî karbona alfa tê navkirin.[5] Bendek karbonê bi hîdrojenê ve girêdayî ye, bendê duyem bi koma karboksîlê, a sêyem bi koma amînê ve giredayî ye. Van hersê bêş di pêkhateya hemû asîdên amînî de hevpişk in. Bendê çaremîn a karbona navendî bi zincîra talî (koma guhêrbar) ve girêdayî ye. Zincîra talî wekî koma fermanî (bi înglîzî: functional group) tê navkirin û bi tîpa R tê nîşankirin.[6]
Cudahiya asîdên amînî ji ber cora koma fermanî ye.[7] Ango di xaneyên mirov de 21 corên koma fermanî (R) heye. Her asîdek amînî, koma fermaniyek bêhempa lixwe digire. Di hin aa de koma fermanî sade ye. Wekî mînak zincîra talî ya asîda amînî ya glîsîn tenê ji hîdrojenek pêk tê. Zîncîra talî di asîdên amînîyên din de aloztir e. Zincîra talî di hinek aa de çeqdar e, di hinek aa de xelekî ye.[7]
Hejmara asîdên amînî
[biguhêre | çavkaniyê biguhêre]Li gor pirraniya çavkaniyan, di pêkhateya proteînên mirov de 20 cor asîdên amînî cih digire. Di van salên dawî de di xaneyên zîndeweran de du asîdên amînî yên nû hat keşfkirin. Ji vana, asîda amînî ya bi navê seleonosîstîn (bi înglîzî: selenocysteine) di sala 1986ê de hat keşfkirin, ev aa di xaneyên mirov de cih digire, lê asîda amînî ya bi navê pîrolîzîn (bi înglîzî: pyrrolysine) a ko di sala 2002 de hat kefşkirin di pêkhateya proteînên mirov de cih nagire. Ango di xaneyên zîndeweran de herî zêde 22 cor asîdên amînî heye, lê di proteînên xaneyên mirov de 21 cor aa heye.[8] Di pêkhateya hin proteînan de ji bilî 21 asîdên amînî, hin asîdên amînî yên neasayî jî cih digirin. Ev asîdên amînî ji guhertina asîdên amînî yên asayî tên çêkirin. Wekî mînak, di pêvajoya dirustbûna kolojenê de, asîda amînî ya lîzîn û ya prolîn tên guhertin bo asîdên amînî yên hîdroksîlîzîn (bi înglîzî: hydroxylysine) û hîdroxsîprolîn (bi înglîzî: hydroxyproline). Ev herdu asîdên amînî yên nû, di navbera bendên peptîdî yên kolojenê de girêdanên çeprast ava dikin. Bi vî awayî molekula kolojenê zexmtir dibe, kolojen xurtî û qewînî dide kirkirk û hestiyan.[9]
Çavkaniya asîdên amînî ya laşê mirov
[biguhêre | çavkaniyê biguhêre]Baweriya gellek zanyar ev e ko asîdên amînî yek ji molekulên pêşîn in ko li ser ruyê erdê peyda bûnê. Wisa tê pêşbinîkirin ko cara ewil, asîdên amînî di deryayê de peyda bûne.[10]
Ji bo asîdên amînî yên laşê mirov du çavkanî heye. Mirov di xaneyên xwe de ji molekulên din (asîdên çewrî, glukoz) asîdên amînî berhem dike. Herwisa xurekên bi proteînî jî çavkaniya duyem e ji bo dabînkirina asîdên amînî.[6]
Li gel hin istisnayan, riwek û zîndewerên navikseretayî (bakterî û arke), dikarin hemû corên asîdên amînî di xaneyên xwe de ji molekulên din berehem bikin. Ajal di xaneyên xwe de ne hemû lê dikarin hinek asîdên amînî berhem bikin. Asîdên amînî yên ko di xaneyên ajalan de nayên berhemkirin wekî asîdên amînî yên bingehîn (bi înglîzî: essential amino acids ) tên navkirin. Mirov asîdên amînî yên bingehîn ji xurekên biproteînî bi dest dixe.[1]
Goşt bi proteînan dewlemende. Gava mirov goştê ajalek dixwe, proteînên wê ajalê werdigire. Di laşê mirov de proteîn ji aliyê koendama herisê ve tê heriskirin. Ji hilweşîna proteînan, asîdên amînî peyda dibe. Asîdên amînî tevlê xwîna mirov dibe û di xaneyan de ji bo çêkirina proteînên mirov tên bikranîn.
Hejmara asîdên amînî yên bingehîn ji bo zarokan 10, ji bo mirovên pêgihiştî 9 e.[9][1]Îzolusîn, lusîn, lîzîn, metîonîn, fenîlalanîn, tireonîn, trîptofan, valîn, û hîstîdîn 9 asîdên amînî yên bingehîn in ji bo mirovên pêgihiştî. Zarok li gel van 9 aa, nikarin bi têra xwe asîda amînî ya arjînîn jî di xaneyên xwe de berhem bikin.[9]
Asîdên amînî û rêkxistina pH-ya hawîrdorê
[biguhêre | çavkaniyê biguhêre]Asîdên amînî di gîraweya pH-ya nêtar (neutral) de bi gelemperî bi şêweyê îyonên ducemser in. Ango di xaneyê de koma karboksîl (—COOH) hîdrojenek dide û dibe îyona (—COO )-. Herwisa koma amîn (—NH2) jî hîdrojenek digire û dibe îyona —NH3+. Bi vî awayî koma karboksîlî ya asîda amînî bi bargeya negatîf, koma amînî jî bi bargeya pozîtîf tê barkirin.[9] Ji ber ko koma karboksîl û koma amîn a asîdên amînî hîdrojen berdidin an jî hîdrojen werdigirin, asîdên amînî wekî rêkxistinerê pH-yê (buffer) kar dikin û xaneyê ji guherîna pH-yê diparêzin.[9]
Asîdên amînî wekî molekulên amfoter (bî înglîzî: amphoteric) tên navkirin.[11] Di hawirdora asîdî de koma amînî ya asîda amînî mîna baz (tift) bi asîda hawîrdorê dikeve reaksiyonê û asîdiya hawirdorê hinek kêm dike. Herwisa di hawirdorek alkalî de koma karboksîl jî mîna asîd bi baza hawîrdorê dikeve reaksiyonê û asta alkalîbûna hawirdorê hinek kêm dike. Ango asîdên amînî ji ber taybetmendiyên xwe yên amfoterî, pH-ya hawirdorê rêk dixin.[11]
Hemû asîdên amînî di şileya laş a derdora pH-ya ≈ 7- 7.4 de bi şêweyê iyonî ne. Koma karboksîlê bi bargeya negatîf, koma amînî jî bi bargeya pozîtf barkiriyê. Heke di molekulek de bargeya negatîf a komek û bargeya pozatîf a koma heman molekulê yeksan bin ew molekul wekî molekula zwîtterîon (bi almanî: zwitterion) tê navkirin.[12]Peyva “zwitter” di zimanê almanî de ji bo rewşa duregbûnê an jî hermafrodîtiyê tê bikaranin. Hemû asîdên amînî di pH-yek taybet de zwîtterîon in. Asîdên amînî yên necemsergir û yên cemsergir û nebibargeyî di laş de di rewşa zwîtterîon de ne. Asîdên amînî yên cemsergir ên bargeyî jî di pH-yek diyarkirî de digihîjin asta zwîtterîonê. Zwîtterîoniya asîdên amînî kar dike bo rêkxistina pH-ya xaneyê an ji şileya laş.
Corên asîdên amînî li gor rewşa cemsergiriyê
[biguhêre | çavkaniyê biguhêre]Ji ber ko di hin beşên proteînê de, di navbera zincîrên talî de girêdan ava dibe, pêkhateya kîmyayî ya zincîra talî girîng e ji bo pêkhateya proteînê. Ango zincîra talî (koma fermanî) bandor li ser şêweyê proteînê dike.[13] Asîdên amînî li gor taybetmendiya kîmyayî ya zîncîra talî tên polenkirin.[10] Di zîncîra talî de rewşa dabeşbûna bargeyên karabe ya bi şeweyê neyeksanî, wekî cemsergirî tê navkirin.

Asîdên amînî yên necemsergir
[biguhêre | çavkaniyê biguhêre]Pirraniya asîdên amînî zincira talî ya necemsergir (bi îngîlîzî: nonpolar) lixwe digirin. Neh asîdên amînî zincira talî ya necemsergir lixwe digirin. Koma fermanî(R) ya van asîdên amînî -CH2 an jî -CH3 lixwe digirin. Alanîn, valîn, lusîn, îzolusîn, prolîn, fenîlalanîn, metîonîn, trîptofan û glîsîn asîdên amînî yên necemsergir in.[2]
Asîdên amînî yên cemsergir û bibargeyî
[biguhêre | çavkaniyê biguhêre]Hin asîdên amînî cemsergir in (bi înglîzî: polar) û zincîra talî ya bargeyî (bi înglîzî: charged) ya bi bargeya pozîtîf an jî ya bi bargeya negatîf lixwe digirin. Di vê komê de şeş asîdên amînî cih digire. Zincîra talî ya van asîdên amînî îyonê asît an jî îyonê baz lixwe digirin. Lîzîn, arjîn, pîrolîzîn û hîstîdîn asîdên amînî yên bi taybetmendiya baz (tift) in. Asîda glutamî û asîda aspartî jî asîdên amînî yên bi taybetmendiya asîd in.[2]
Asîdên amînî yên cemsergir û nebargeyî
[biguhêre | çavkaniyê biguhêre]Hinek ji asîdên amînî cemsergir in lê zincîra talî ya nebargeyî (bi înglîzî:uncharged) lixwe digirin.[13] Koma asidên amînî yên cemsergir ên nebargeyî ji şeş asîdên amînî pêk tê. Sîstîn, tîrozîn, glutamîn, asparajîn, trîonîn, serîn û selenosîstîn aa yên cemsergir ên nebargeyî ne. Ji xeynî sîstînê, di pêkhateya zincîra talî ya van asîdên amînî de oksîjen an jî koma hîdroksîl (OH) cih digire.[10]
Asîdên amînî yên aromatî
[biguhêre | çavkaniyê biguhêre]Zincîra talî ya hin asîdên amînî, molekulek xelekî ya şeşgoşeyî lixwe digre, ji van asîdên amînî re tê gotên asîdên amînî yên aromatî (bi înglîzî: aromatic amino acids). Ji koma asîdên amînî yên necemsergir, fenîlalanîn û trîptofan di vê kome de jî tê polenkirin. Herwisa tîrozîn jî li gel koma asîdên amînî yen cemsergir ên bêbargeyî, di vê komê de jî tê polenkirin.[10]
Dijavbûn û avxwazbûna asîdên amînî
[biguhêre | çavkaniyê biguhêre]Asîdên amînî li gor taybetmendiya dijavbûn an jî avxwazbûna koma fermanî (koma talî), di du beşan de tên polenkirin; asîdên amînî yên dijav (bi înglîzî: hydrophobic) û asîdên amînî yên avxwaz (bi înglîzî: hydrophilic).
Asîdên amînî yên dijav, molekulên avê then (pal) didin, loma di hawirdorek avî de aa ya dijaw, di aliyê navî yê proteînê de, ji avê dûr cih dibe. Asîdên amînî yên dijav di hawirdora avî ya bi bi pH-ya nêtar (pH ≈ 7) de îyonîbûn (ionize) nabin, di avakirina bendên hîdrojenî de cih nagirin. Asîdên amîni yên necemsergir dijav in.[14]
Asîdên amînî yên avxwaz di hawirdora avî de çalak in, li aliyê derveyê proteînê de cih digirin û dikarin bendên hîdrojenê ava bikin.[11] Asîdên amînî yên cemsergir avxwaz in.[9] Asîdên amînî yên avxwaz dabeşê sê koman dibin; aa yên cemsergir ên bêbargeyî, aa yên cemsergir ên bi koma talî ya bi bargeya pozîtîf (asîdî), aa yên cemsergir ên bi koma talî ya bi bargeya negatîf (bazî (tiftî). Asîdên amînî yên ko di koma talî de koma karboksîlê lixwe digirin û bi bargeya negatîf barkirî ne aa yên asîdî ne.(asîda glutamî û asîda aspartî). aa yên ko di koma talî de koma amînî lixwe digirin û bi bargeya pozîtîf barkirînê, aa yên bazî (tiftî) ne. Pîrolîzîn, lîzîn, hîstîdîn û arjînîn aa yên bi taybetmeniya bazî ne. Ji ber ko di asîdên amînî yên asîdî û bazî de koma talî cemsergir e, koma talî yê van asîdên amînî jî avxwaz e.[14]
Çavkanî
[biguhêre | çavkaniyê biguhêre]- ^ a b c Rye, C., Wise, R., Jurukovski, V., Desaix, J., Choi, J., & Avissar, Y. (2017).Biology. Houston, Texas : OpenStax College, Rice University,
- ^ a b c Cullen, K. E. (2009).Encyclopedia of Life Science. Newyork: Facts On File, Inc
- ^ Gutiérrez-Preciado, A., Romero, H. & Peimbert, M. (2010) An Evolutionary Perspective on Amino Acids. Nature Education 3(9):29
- ^ Alberts, B., Johnson, A., Lewis, J., Morgan, D., Raff, M., Roberts, K., & Walter, P. (2014). Molecular Biology of the Cell (6th ed.). NY: Garland Science.
- ^ Brooker, R., Widmaier, E., Graham, L., & Stiling, P. (2017). Biology (4th ed.).
- ^ a b Berk, A., Kaiser, C. A., Lodish, H., Amon, A., Ploegh, H., Bretscher, A., & Krieger, M. (2005). Molecular Cell Biology (5th ed.). CA.
- ^ a b Simon, E. J., Dickey, J.L., Reece, J. B., & Burton, R. A. (2018).Campbell Essential Biology with Physiology (6th ed.). Newyork, United States: Pearson.
- ^ Lopez MJ, Mohiuddin SS. Biochemistry, Essential Amino Acids. [Updated 2023 Mar 13]. In: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing; 2023 Jan-. Available from: [1]/
- ^ a b c d e f Solomon, E., Martin, C., Martin, D., & Berg, L. (2015).Biology. Stamford: Cengage Learning.
- ^ a b c d Losos, J., Mason, K., Johnson,G., Raven, P., & Singer, S. (2016). Biology (11th ed.). New York, NY: McGraw-Hill Education.
- ^ a b c Rittner, Don, and Timothy Lee McCabe. Encyclopedia Of Biology. Facts On File, 2004.
- ^ Helmenstine, Anne Marie, Ph.D. "Definition of Zwitterion." ThoughtCo, Feb. 16, 2021, thoughtco.com/definition-of-zwitterion-604702.
- ^ a b O'Connor, C. M. & Adams, J. U. Essentials of Cell Biology. Cambridge, MA: NPG Education, 2010
- ^ a b Campbell, N. A., & Reece, J. B. (2008). Biology (8th ed.). San Francisco, CA: Benjamin-Cummings Publishing Company.
