Proteîn
Proteîn molekulên aloz (makromolekul) û polîmer in, ji yek an jî zêdetir zincîrên asîdên amînî pêk tên.
Di xaneyên zîndeweran de karbohîdrad, çewrî, proteîn, vîtamîn û asîdên nukleyî molekulên endamî (organîk) yên sereke ne. Lê di xaneyê de herî zêde molekûlên proteînî cih digire[1].
Zêdetirê ji %50 yê giraniya (giraniya ziwa) xaneyê ji proteînan pêk tê[2]. Di xaneyên zindeweran de ne yek lê gelek corên proteinan heye. Zanyariyên bomaweyî yên li ser ADN-yê cora proteîna zîndewerê diyar dike[3]. Li gor zanyariyên bomaweyî di navbera asîdên amînî de bendên kîmyayî ava dibe û proteîn peyda dibe. Cor, rêz û hejmara asîdên amînî yên bi hev re bi bendên peptîdî hatine girêdan, cora proteînê diyar dike. Her xaneyek bi hezaran cor proteîn lixwe digire[1]. Xaneyên laşê mirov bi qasî 32000 corên proteînan lixwe digire[4].Herwisa di laşê zindewerk de jî dibe ko her endam proteinek taybet lixwe bigire. Wekî mînak, proteînên masûlkeyên mirov, ji yên mejî û kezeba mirov cudatir in [5].
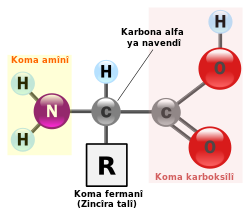
Molekulên proteînê li gor molekulên şekir an jî molekulên rûnê (çewrî) gelek gir in û ji girêdana gelek asîdên amînî pêk tên. Piraniya proteînan bi dirêjiya 50 heta 2000 asîdên amînî ne[6].
Proteîn di laş de gelek erkên girîng pêk tînin. Tora proteînên nav xaneyê, peykerê xaneyê, şêweyê xaneyê sabît dike û hemû pêkhateyên xaneyê ji belavbûnê diparêze. Rîşalên proteînên aktîn û miyozîn girjbûna masûlkeyan rêk dixe. Proteîna hemoglobîn di nav xwînê de oksîjen û hinek karbona dioksîd diguhazîne. Dijeten ji proteînan pêk tên. Di laş de di nav xwînê û lîmfê de li dij hokarên nexweşiyê kar dikin. Hema hemû enzîm ji proteînan pêk tên. Enzîm bandor li karlêkên (reaksiyon) kîmyayî dikin bo bi destxistina enerjî, sazkirina malekulên nû an jî hilweşîna molekulan. Herwisa enzîm kar dikin ji bo çêkirina proteînan û duhendebûna ADN-yê. Proteînên wergir rê dide xaneyê ko hormon û guherînên hawirdorê hest bike û bertek nîşan bide[7] .
Herwisa hestî, jê, bester, çerm, por û nînokên mirovan zexmiya xwe ji proteînan digirin. Hin corên hormonan ji proteînê pêk tên. Wekî mînak hormona însulîn û hormona geşê, proteînên gogî ne.
Ji bakterîyek heta mirovan, proteînên her zîndewerek taybet e ji bo wê zîndewerê. Proteînên her mirovek ji mirovek din piçek cuda ye, wekî mînak, rengê çavê mirov, porê mirov û rengê çermê mirov ji hev piçek cihê ne. Her wisa komeleya xwîna mîrovan jî ji hev cudatir e. Sedemên van cudahiyan, cudahiya proteînan in. Tenê proteînên cêwiyên tekzîgotê (yekhêkê) wekî hev in [8].Her çiqas proteînên zîndeweran ji hev cuda bin jî,lê proteînên hemû zîndeweran ji 20 cor asîdên amînî pêk tên. Ango mirov, riwek an jî bakterî heman asîdên amînî bi kar tînên û proteînên xwe yên taybet çêdikin[9]. Hemû zîndewer proteînên xwe ji asîdên amînî yên di xaneyên xwe de çêdikin. Di rewşa asayî de di xaneyekê de ji 20 corên asîdên amînî bi têra xwe heye. Gava pêdiviya xaneyê bi proteînek hebe, asîdên amînî yen nav xaneyê tên bikaranîn. Heke di xaneyê de ji asîdek amînî ya bingehîn bi têra xwe tune be, çêbûna proteîn hêdî dibe an jî tê sekinandin[10]. Cora proteînan, şêwe û erkê xaneyê diyar dike. Wekî mînak, xaneyên masûlke ji bo girjbûn û xavbûnê, bi qebareyek zêde ji proteînên miyozîn û aktîn lixwe digirin. Di xirokên sor de herî zêde proteîna hemoglobîn cih digire, hemoglobîn kar dike bo guhaztina oksîjen û hinek karbona dîoksîde di nav xwînê de[1].
Bendê peptîdî[biguhêre | çavkaniyê biguhêre]


Gava du asîdên amînî bi hevdu re tên girêdan, ji koma karboksîle ya asîda amînî ya yekem, îyona hîdroksîl (OH-), ji koma amînî ya asîda amînî ya duyem jî hîdrojenek (H+) diqete. Bi vî awayî di asîda amînî ya yekem de di atoma karbonê de, di asîda amînî ya duyem de di atoma nîtrojenê de bendek serbest (vala) dimîne. Ev herdu bendên vala bi hev re tên girêdan, ev girêdana navbera asîdên amînî wekî “bendê peptîdî” tê navkirin. Hîdroksîl (OH-) û hîdrojena (H+) ji asîdên amînî hatine berdan yek dibin û molekulek av (H2O) peyda dibe[11] .
Molekula ji du asîdên amînî yên bi bendê peptîdê girêdayî pêk tê, wekî “dîpeptîd” tê navkirin[12]. Heke sê asîdên amînî bi hev re werin girêdan, molekula nû wekî “trîpeptîd”, bi yekbûna çar asîdên amînî molekûla nû wekî “tetrapeptîd” tê navkirin. Gava gelek asîdên amînî bi bendên peptîdê bi hev re tên girêdan û ji asîdên amînî zincîrek dirêj ava dikin, ev zîncîr jî wekî polîpeptîd (firepeptîd) tê navkirin.
Peyva polîpeptîd û peyva proteîn ne heman tişt in[13]. Proteînek dibe ko ji yek an jî zêdetir polîpeptîdan pêk were[2]. Proteînek çalak bi gelemperî ji polîpeptîdên bi şeweyek taybet badayî û qatbûyî pêk tê.Gava zincîra polîpeptîdê tê avakirin, asîdên amînî bi awayekî taybet li dû hev rêz dibin. Di zincîrê de asîda amînî ya yekem bi beşa koma karboksîlê ve bi koma amînî ya asîda amînî ya li pêy xwe ve girêdana peptîdî ava dike. Ango koma amînî(-NH2) ya asîda amînîya yekem serbest dimîne, loma ev kotahî wekî kotahiya -N (N-terminus) tê navkirin. Di zîncîra polîpeptîdê de koma amînî ya asîda amînî ya dawî bi koma karboksîlê (-COOH) ya asîda amînîya pêş xwe ve girê dibe. Bi vî awayî di asîda amînî ya dawîn de koma karboksîlê serbest dimîne, ev ebeş wekî kotahiya-C (C-terminus) tê navkirin[14]. Gava polîpeptîd tê avakirin, zincîra polîpeptîdê ji kotahiya-N ber bi kotahiya-C ve dirêj dibe[15].
Şêwe û pêkhateya proteînan[biguhêre | çavkaniyê biguhêre]

Şeweyê proteîn raste rast bandor li ser erk û çalakiya proteînê dike. Wekî mînak, enzîmek dikare tenê bi corek substrat ve were girêdan[14] . Rûxarê çalak a enzîmê û rûyê substradê li hev diguncin. Heke ji ber hin sedeman rûxarê çalak a enzîmê biguhere, enzîm nikare bi substaradê ve were girêdan û çalakiya enzîmê radiweste. Şêweyê hormonên proteînî taybet e ji bo wergirên ser rûyê xaneyê. Loma hormon dikarin xwe bi wergirên xaneya armanc ve girê bidin[1].
Di zîncîra polîpeptîda proteînê de guherîna yek asîdek amînî, dibe ko bibe sedema guherînek mezin di şêwe û erkê proteînê de. Wekî mînak, di nexweşiya kêmxwîniya xaneya dasî de, di hemoglobîna asayî de guherîna asîdek amînî rû dide. Hemoglobîna asayî proteînek gogî ye, lê di kesên bi kêmxwîniya xaneya dasî de, hemoglobîn gava bi oksîjenê ve girêdayî ye, bi şêweyê gogî ye, lê gava oksîjenê ber dide şêweyê hemoglobînê diguhere. Herwisa guherîna hemoglobînan bandor li ser xirokên sor (xaneyên xwînê) jî dike. Xirokên sor ên asayî bi şêweyê xepleyî ne, guherîna asîda amînî şeweyê xirokên sor diguherîne bo şeweyê dasî. Ev xirokên sor ên bi şêweyê dasî di hin beşên mûlûleyên xwînê de kom dibin û naherikin, loma kesên bi vê nexweşiyê ne, dibe ko di xane û şaneyên wan de bi têra xwe oksîjen belav nebe[16].
Proteîn li gor pêkhateya molekula xwe, çar cor in,
pekhateya yekemî (bi înglîzî: primary structure),
pêkhateya duyemî (bi înglîzî: secondary structure),
pêkhateya sêyemî (bi înglîzî: tertiary structure)
û pêkhateya çaremî (bi înglîzî: quaternary structure).
Herwisa proteîn li gor şeweyê xwe jî dabeşî du cora dibin, proteînên gogî û proteînên rîşalî. Hemoglobîn, amîlaz û însulîn mînak in ji bo proteînên gogî. Aktîn û miyozîn jî proteînên rîşalî ne[17].Proteînên rîşalî bi pêkhateya duyemî, proteînên gogî jî bi pêkhateya seyemî an jî çaremî ne.
Pêkhateya yekemî[biguhêre | çavkaniyê biguhêre]

Zincîra asîdên amînî yên polîpeptîdê, pêkhateya yekemî ya proteînê ye. Ji ber ko rêza asîdên amînî yen polîpeptîdê ji aliyê ADN-yê ve tê diyarkirin, ji 20 corên asîdên amînî her asîdek amînî dibe ko di zîncîra proteînê de bi hejmarek corbicor û di rêzek cuda de cih bigire, loma pekhateya yekemî ya her proteînek ji ya din cuda ye[11].
Pêkhateya duyemî[biguhêre | çavkaniyê biguhêre]
Pêkhateya duyemî ya proteînê bi avakirina bendên hîdrojenê, bi badan û kurîşkên polîpeptîdê ava dibe. Bendê hîdrojenê di navbera koma N-H û koma C=O ya zincîra polîpeptîdêk an jî polîpeptîdan de ava dibe[6]. Bi gelemperî du corên pêkhateya duyemî ya proteînan heye, lûlpêça alfa û pela kurîşkî ya beta.
Keratîn û kolojen proteînên bi pêkhateya duyemî ne. Por û nînokên mirov, hirî û qiloçên ajal ji proteîna keratînê çêbuyî ne. Herwisa proteîna kolojenê di nav hestî, kirkirik û masûlkeyên ajalan da gelek pir e.
Du an jî zêdetir deverên zincîra polîpeptîdê li kêlaka hev dirêj dibin û bi bendên hîdrojenê bi hev re tên girêdan, bi vî awayê pela kurîşkî ya beta peyda dibe[13]. Proteîna fîbroîn, beşa sereke ya pêkhateya hevrişîmê (bi înglîzî: silk) ye. Fîbroîn mînak e ji bo pekhateya duyemî ya proteînên cora pela kurîşkî ya beta[1].
Di lûlpêça alfa de, oksîjena ji koma karboksîl a her bendek peptîdê, bi hîdrojena koma amînî ya asîda amînî ya çaremîn a ber bi kotahiya -C ve, bi bendê hîdrojenê tê girêdan. Avakirina bendan di dirêjiya polîpeptîdê de didome, bi badana vê beşa polîpeptîdê, polîpeptîda bi şêweyê lûlpêç peyda dibe[4].Çerm, por, nînokên mirov, qiloç û simên ajalan, proteîna alfa keratîn lixwe digirin. Proteîna alfa keratîn proteînek bi pêkhateya duyemî û ji cora lûlpêça alfa ye[6].
Pêkhateya lûlpêça alfa û pela kurîşkî ya beta di nav pirraniya proteînên gogî û rîşalî de cih digirin[14].Herdu corên pêkhateya duyemî jî bi awayekî herî zêde rê vedikin ji bo bendên hîdrojenê, loma proteînên bi pêkhateya duyemî molekulên xweragir in[15].
Pêkhateya sêyemî[biguhêre | çavkaniyê biguhêre]

Şêweyê sê dûrî (3D) ya tevahiya zincîra polîpeptîdê wekî pêkhateya sêyemî tê navkirin. Şeweyê sê dûrî ji aliyên çar hokarên serekeyên ko bi têkiliya navbera komên-R (komên fermanî) yên heman polîpeptîdê ve tê diyarkirin[1].Bi alîkariya van hokaran zincîra polîpepdîdê ya ko ji beşên lûlpêça alfa û beşên pela kurîşki ya beta pêk tê, hê pirtir tên badan, lûlkirin û qatkrin bi vî awayê pêkhateya seyemî ya bi şeweyê sê dûrî ya proteînê peyda dibe[15].
Hokarên dîyarkerê pêkhateya sêyemî[biguhêre | çavkaniyê biguhêre]
1. Avakirina bendên hîdrojenê: Di navbera koma fermanî ya hin asîdên amînî yên polîpeptîdê de bendên hîdrojenî tê avakirin.
2. Avakirina bendên iyonî: Di navbera koma fermani ya bi bargeya negatîf û komek fermanî ya bi bargeya pozîtîf de bendê îyonî tê avakirin. Herwiha di proteînê de komên fermanî yên nebargeyî jî di navbera xwe de bendên îyonî ava dikin[18].
3. Hevkarîgeriyên dijavî (bi înglîzî: hydrophobic interactions) : Ava hawirdorê komên fermanî yên necemser tehn didin, komên fermanî ji aliyê hawirdora avî dûr dikevin û li aliyê navî yê goga proteînê de kom dibin[14].
4. Avakirina bendên hevbeş (kovelendî): Di navbera atomên sulfura du sîstînên polîpeptîdê de bendê kovelendî ava dibin, ev bend wekî bendên dîsulfîd an jî pirên dîsulfîd (bi înglîzî: disulfide bridges) tên navkirin.
Bendên hîdrojenê, bendên îyonî û hokara dijavî, hevkarîgeriyên lawaz in, bendên dîsulfîdî yên kovelendî bendên bihêz in[1].
Pêkhateya çaremî[biguhêre | çavkaniyê biguhêre]
Pêkhateya çaremî ya proteînê jî wekî mîna pêkhateya sêyemî bi bandora bendên hîdrojenê, bendên îyonî, hevkarîgeriyên dijavî û bendên kovelendî ava dibe. Pêkhateya çaremî ya proteînan ji çendan polîpeptîdan pêk tê[14]. Wekî mînak kolojen proteînek rîşalî ye û ji sê polîpepdîdan pêk tê, hemoglobîn proteînek gogî ye û ji çar polîpeptîdan pêk tê. Herwisa dijeten jî ji çar zincîrên polîpeptîdê yên bi bendên dusulfîdî girêdayî pêk tê û kar dike ji bo bergiriya laş[1].
Şaperon[biguhêre | çavkaniyê biguhêre]
Gava di rîbozoman de proteîn tên çêkirin, pêkhateya pêşîn zîncîra polîpeptîdê ye. Zincîra polîpeptîd bi badan, çemîn û qatan şêweyê xwe yê sê dûrî yê taybet çêdike. Bi gelemperî qatbûn û badana proteînê bi xwe rû dide, lê gelek caran jî proteînên taybet ên bi navê şaperon (bî înglîzî: chaperone) alîkarî dike ji bo qatbûn û çemîna polîpeptîdê. Herwiha hin caran qatên proteînan vedibin, şaperon qatên vebûyî cardin qat dike[9]. Şaperon alîkariya qatbûn û badanan dike lê, şêweyê dawî yê proteînê ji aliyê asîdên amînî yên polîpeptîdê ve tê diyarkirin[6].
Erkê Proteînan[biguhêre | çavkaniyê biguhêre]
Ji ber ko di xaneyê de proteîn gelek in, piraniya çalakiyên xaneyê ji aliyê proteînan ve tê rêvebirin. Dabînkirina şewe û pêkhateya xanayê, rêkxistina genan, duhendebûna ADN-yê, di nav xaneyê de guhaztina madeyan, di navbera xaneyê û hawirdorê de alûgorkirina madeyan, çêkirina enzîm, dijeten û pirraniya hormonan hin karên sereke yên proteînên xaneyê ne[19].
Hin proteîn, wekî proteînên di çerm, bester, jê û masûlkeyan de, ji bo xane û şaneyan wekî yekîneyên binyadî kar dikin. Hin proteîn dibin enzîm û di laş de leza karlêkên kîmyayî rêk dixin. Hinek ji proteînan di pêkhateya hormon de cîh digirin, wekî mînak însulîn. Wergirên li ser rûyê parzûna xaneyê û dijeten ên bo bergiriya laş proteîn in[17].Dema dabeşbûna xaneyê de, di xalên kontrolê (bi înglîzî: checkpoints) de gavên dabeşbûnê ji aliyê proteînan ve tê kontrolkirin[20] .
1. Çalakiya enzîman[biguhêre | çavkaniyê biguhêre]
Di biyolojiyê de katalîzorên xaneyê wekî enzîm tên navkirin. Enzîm hin karlêkên (reaksiyon) kîmyayî hêsan dike û leza wê zêde dike. Ji ber vê sedemê, peydabûna enzîman yek ji girîngtirîn bûyerên peresîna jiyanê ye. Enzîm proteînên gogî yên sê dûrî (3D) ne. Enzîm li dora substratê (madeya ko enzîm bandor lê dike) cih dibe. Guncîna rûyê enzîmê bi rûyê substartê, karlêkên kîmyayî leztir dikin[11].
2. Bergirî[biguhêre | çavkaniyê biguhêre]
Hin proteînên gogî, şêweyê xwe ji bo naskirina hokarên nexweşiyê û xaneyên şêrpenceyê bi kar tînin. Ev proteîn wekî wergirên rûyê xaneyê kar dikin û binyata koendama korerijen (hormon) û koendama bergiriyê pêk tînin[11]. Dijeten proteînên taybet in ji bo dabînkirina bergiriya laş. Dijeten di nav xwînê û di nav lîmfê de di tevahiya laş de digerin û hokarên nexweşiyê têk dibin[7].
3. Guhaztin û embarkirin[biguhêre | çavkaniyê biguhêre]
Proteîn bi hin molekulan ve girê dibe û wan diguhazîne. Proteinên gogî molekul û iyonên piçûk diguhazînin. Wekî mînak, hemoglobîn proteîna guhaztinê ye, di nav xwînê de oksîjen û hinek karbona dîoksîdê diguhazîne. Miyoglobîn di xaneyên peykeremasûlkeyê de bi oksîjenê ve girê dibe û oksîjen embar dike[21] .Proteînên guhaztinê yên parzûna xaneyê, alîkarî dikin bo iyon û molekulan ko ji parzûnê (perdeyê) derbas bibin. Transferîn hesin diguhazînê bo kezebê, di kezebê de proteîna ferritîn hesinê di kezebê de embar dike. Rûnên nav xurekan piştê herisê bi navbeynkariya lîpoproteînan di nav xwînê de tên guhaztin[9].Proteînên hilgir û proteînên kanalî yen li ser parzûna xaneyê, di navbera xane û hawirdorê de alûgorkirina madeyan rêk dixin[22].
4.Piştgirî[biguhêre | çavkaniyê biguhêre]
Proteînên rîşalî di pêkhateya hin beşên laş de cih digirin. Keratîna nav por, fîbrîna nav xwîna meyînî de û kolojen hin mînakin bo proteînên rîşalî. Kolojen di çêbûna matrîksa çerm, bester, jê û hestiyan de kar dike. Di laşê birrbirredaran de proteîna herî zêde kolojen e.
5. Livîn[biguhêre | çavkaniyê biguhêre]
Girjbûna masûlkeyan bi xilisîna rîşalên proteînî yên bi navê deziyê aktîn û deziyê miyozîn rû dide. Miyozîn deziyê aktînê li ser xwe de kaş dike û masûlke girj dibin. Herwiha proteînên girjker kar dikin bo pêkanîna kakûtê xaneyê û guhaztina madeyan di nav xaneyê de.
6. Rêkxistin[biguhêre | çavkaniyê biguhêre]
Proteînên piçûk ên wekî hormon tên navkirin, di xanyên zîndeweran de wek peyamberên navxaneyî kar dikin. Proteîn di xaneyê de ji bo rêkxistina gelek zîndeçalakiyan kar dikin wekî mînak, dema peresînê de, hin genên xaneyê vedikin hinekan jî digirin bi vî awayî geşe û peresîna xaneyê rêk dixin. Herwiha proteîn li ser parzûna xaneyê de wekî wergirên rûyê xaneyê kar dikin û ji hawirdorê agahî kom dikin. Di xaneyê de sinyalên demarî bi navbeynkariya wergirên ji proteînî yên li ser parzûna xaneyê ve tên wergirtin[22].Albumîn, globîlîn û fîbrînojen proteînên plazmayê ne[23]. Proteînên plazmaya xwînê ji bo rêkxistina pestoya osmozî kar dikin, fîbrînojen dema brîndarbûnê de çalak dibe û dibe fîbrîn. Fîbrîn alîkarî dike ji bo meyîna xwîna ser birînê.
8. Dabînkirina enerjî[biguhêre | çavkaniyê biguhêre]
Mirov li gel karbohîdrat û çewriyan, di birçîmayîna demdirêjî de ji proteînan jî enerjî bi dest dixin. Lê di laş de embara proteînan tûne, loma bikaranîna proteînan bi taybetî ziyan dide masûlkeyan û masûlke lawaz dibin[24].
9.Tevlêbûna pêkhateyê[biguhêre | çavkaniyê biguhêre]
Proteînên binyadî, di gelek beşên xaneyê de cih digirin. Dûçika spermê, dûçika bakteriyan, ji proteînan pêk tê û kar dikin ji bo livîna xaneyê. Mîkrotubulên nav xaneyê proteînên taybet in, di nav xaneyê de guhaztina madeyan dabîn dikin û wekî peykerê mirov, piştgiriyê didin xaneyê. Di xaneyên masûlkeyan de proteînên rîşalî girjbûn û xavbûna masûlkeyê rêk dixin[19]. Herwisa li derveyê xaneyan jî kolojen û keratîn proteîna herî belavî ye, di pêkhateya hestî, jê, bester, por çerm û neynûkan de cih digirin.
Proteînên hevgirtî[biguhêre | çavkaniyê biguhêre]
Komek mezin a proteînan wekî proteînên hevgirtî (bi înglîzî: conjugated proteins) tên navkirin. Proteînên hevgirtî ji yekbûna proteîn û beşa neproteînî pêk tên.
Heke proteîn û molekulên çewrî yekgirtî bin, navê wê lîpoproteîn e.
Heke proteîn bi molekulên karbohîdradî ve girêdayî be vê gavê navê wê glîkoproteîn e[3].
Heke proteîn bi fosfatê ve yekbûyî be, navê wê fosfoproteîn e.
Proteinên bi koma hem ve girêdan avakirîne, wekî hemoproteîn tên navkirin. Wekî mînak hemoglobîn û miyoglobîn.
Proteînên bi pîgmentên karotenoîd, pîgmentên zeravê an jî melanînê ve girêdayî jî wekî kromoproteîn tên navkirin.
Hin proteîn jî bi asîdên nukleyî ve hevgirtîne, navê van proteînan nukleoproteîn e.
Proteînên parzûna xaneyê[biguhêre | çavkaniyê biguhêre]
Li ser parzûna xaneyê de gelek corên proteînan cih digire, her yek ji bo karek taybet e[25]. Ji bo proteînên ser parzûna xaneyê, navê “proteînên perdeyê” tê bikaranîn.
Proteînên cogî (bi înglîzî: channel proteins): Ji parzûna xaneyê de derbasbûna madeyên dijav an jî madeyên di nav avê de dihelin bi navbeynkariya proteînên cogî rû dide.
Proteînên hilgir (bi înglîzî: transport proteins): Di parzûna xaneyê de difuzyona hêsankirî (bi înglîzî: facilitated diffusion) bi navbeynkariya van proteînan rû dide.Wekî mînak glukoz bi navbeynkariya van proteînan derbasî nav xaneyê dibe[20]. Herwisa proteînên hilgir bi veguhaztina çalak, bi xerckirina enerjiya ATP-yê jî hin molekulan ji parzûna xaneyê derbas dikin.
Proteînên nasînê (bi înglîzî: recognition proteins): Evana glîkoproteînên taybet in ji bo naskirina xaneyên cîran.
Proteînên nüsek (bi înglîzî: adhesion proteins): Xaneyê bi xaneya cîran ve girê dide, an jî ji bo rîşal û tubulên navxaneyê girêdanê dabîn dikin ko peykerê xaneyê zexm bibe.
Proteînên wergir (bi înglîzî: receptor proteins): Ev proteîn gava hormon an jî madeyêk hander bi proteîna wergir ve girê dibe, proteîn di xaneyê de berteka guncav dide destpêkirin.
Proteînên guhaztînerê elektronan (bi înglîzî: electron transfer proteins) : Dema karlêkên kîmyayî rû dide, ev proteînan elektronan ji molekulek diguhazînin bo molekula din[25].
Denaturasyona proteînan[biguhêre | çavkaniyê biguhêre]
Dema proteîn rastê germahiya zêde, asîda bihêz, baza bihêz an jî hin rewşên neasayî tê, pêkhateya wê xira dibe şêweyê wê yê asayî diguhere, ji vê rewşa proteînê re denaturasyon (bi înglîzî: denaturation) tê gotin[10].
Denaturasyon guherîna kîmyayî an jî fîzîkî ya pêkhateya proteînê ye. Tiştên ko dibin sedema rûdana denaturasyonê jî wekî hokarên denaturasyonê tên navkirin.
Proteîna denaturebûyî ji ber ko şeweyê xwe yê taybet winda dike, êdî nikare erkê xwe bîne cih[10]. Wekî mînak heke hinek ava leymûnê li şîr were zêdekirin, dî nav şîrê de hinek ji proteînên ji hev cuda, ji ber asîda bihêz a ava leymûnê, bi hev ve dizeliqin û wekî gilokên hûrik di nav şileyê de kom dibin, hinek proteîn jî di nav ava şîrê de wekî şijû dimînin, ev rewş wekî qûsîna şîr tê navkirin. Şîrê qûsiyaye, pH-ya wê cardin were bilindkirin jî, êdî venagere rewşa berê. Ango denaturasyona proteînan bi gelemperî mayînde ye. Herwiha germahiya bi pileya bilind jî dibe sedema denaturasyona gelek proteînan. Mînak, gava hêk tê kelandin, ji ber germahiya hawirdorê qat û badokên proteînên spîka hêkê vedibin, şêweyê asayî yê proteînan diguhere û di navbera proteînan de girêdanên nû ava dibe[16]. Ev şêweyê nû ya proteînan êdî ne herîkbar, lê req e. Hêka kelandî were sarkirin jî venagere şêweyê xwe yê berê[18].
Di denaturasyonê de pêkhateya yekemî ya proteînê naguhere[14], loma hin caran proteîna ko denaturê bûye, ango şêweyê wê yê asayî guheriye, heke hokara denaturasyonê ji hawirdorê were dûrxistin, vedigere şeweyê xwe yê asayî û herwiha erkê xwe yê asayî[26].
Çavkanî[biguhêre | çavkaniyê biguhêre]
- ^ a b c d e f g h Solomon, E., Martin, C., Martin, D., & Berg, L. (2015).Biology. Stamford: Cengage Learning.
- ^ a b Jones, M., Fosbery, R., Gregory, J., & Taylor, D. (2014). Cambridge International AS and A Level Biology Coursebook with CD-ROM (4th ed.). Cambridge, MA: Cambridge University Press
- ^ a b Fox, Stuart Ira.Human Physiology. McGraw-Hill Education, 2016.
- ^ a b Berk, A., Kaiser, C. A., Lodish, H., Amon, A., Ploegh, H., Bretscher, A., & Krieger, M. (2005). Molecular Cell Biology (5th ed.). CA.
- ^ Haurowitz, Felix and Koshland, Daniel E.. "protein". Encyclopedia Britannica, 1 Aug. 2023, https://www.britannica.com/science/protein. Accessed 22 August 2023
- ^ a b c d Alberts, B., Johnson, A., Lewis, J., Morgan, D., Raff, M., Roberts, K., & Walter, P. (2014). Molecular Biology of the Cell (6th ed.). NY: Garland Science.
- ^ a b Murray, G., Murray, J., Granner, & MAYES. (2003). Harper's Biochemistry Illustrated (26th ed.). McGraw-Hill.
- ^ Prescott CA, Kendler KS. Twin Study Design. Alcohol Health Res World. 1995;19(3):200-205. PMID: 31798103; PMCID: PMC6875762
- ^ a b c David L. NelsonMichael M. Cox(2013). Lehninger Principles of Biochemistry. : W. H. FREEMAN AND COMPANY • New York ISBN-13: 978-1-4641-0962-1
- ^ a b c Betts, J., Desaix, P., Johnson, E., Johnson, J., Korol, O., & Kruse, D. et al. (2017). Anatomy & physiology. Houston, Texas: OpenStax College, Rice University,
- ^ a b c d Losos, J., Mason, K., Johnson,G., Raven, P., & Singer, S. (2016). Biology (11th ed.). New York, NY: McGraw-Hill Education.
- ^ Starr, C., & McMillan, B. (2010). Human Biology (8th ed.). Pacific Grove, CA: Brooks/Cole Publishing Company.
- ^ a b Campbell, N. A., & Reece, J. B. (2008). Biology (8th ed.). San Francisco, CA: Benjamin-Cummings Publishing Company.
- ^ a b c d e f Rye, C., Wise, R., Jurukovski, V., Desaix, J., Choi, J., & Avissar, Y. (2017).Biology. Houston, Texas : OpenStax College, Rice University,
- ^ a b c Clark, D. P. (2005). Molecular biology. Elsevier Academic Press.ISBN: 0-12-175551-7
- ^ a b Ireland, K. A. (2010). Visualizing Human Biology (3rd ed.). Hoboken, NJ: John Wiley & Sons.
- ^ a b Cullen, K. E. (2009).Encyclopedia of Life Science. Newyork: Facts On File, Inc
- ^ a b Brooker, R., Widmaier, E., Graham, L., & Stiling, P. (2017). Biology (4th ed.).
- ^ a b Clark, D. P., Pazdernik, N. J., & McGehee, M. R. (2018). Molecular Biology (3rd ed.). London: Academic press,Elsevier.
- ^ a b Postlethwait, J. H., & Hopson, J. L. (2006). Modern Biology. NY, United states: Holt Rinehart & Winston.
- ^ Robert F. Weaver(2010).—5th ed.Published by McGraw-Hill
- ^ a b Guyton, A. and Hall, J., 2011.Guyton And Hall Textbook Of Medical Physiology. Philadelphia: Saunders Elsevier.
- ^ Sembulingam, K., and Prema Sembulingam. Essentials of Medical Physiology. 6th ed., Jaypee Brothers Medical Publishers, 2012.
- ^ Waugh, A., Grant, A., Chambers, G., Ross, J., & Wilson, K. (2014).Ross and Wilson anatomy and physiology in health and illness (12th ed.). Edinburg: Elsevier.
- ^ a b Roberts S. Human Physiology. Global Media, 2007.
- ^ Starr, C. (2007). Biology:concepts and applications (7th ed.). Boston, MA: Cengage Learning.
